Más Información

Diputados designan a Aureliano Hernández, cercano a Colmenares, como nuevo Auditor Superior; estará en el cargo hasta 2034

Aureliano Hernández Palacios, economista y maestro en Políticas Públicas; es el nuevo titular de la Auditoría Superior

Adán Augusto López evita a medios de comunicación en el Senado; "ya no doy entrevistas", dice y huye en taxi

Avanza en Senado fin a pensiones doradas; oposición advierte sobre retroactividad y parcialidad de reforma

Socio de Bermúdez, presunto líder de “La Barredora”, pagó eventos de precampaña de Adán Augusto, cuando éste era “corcholata”

Hernán Bermúdez, líder de "La Barredora", teme ser extraditado a EU; "El abuelo" tramitó amparo para frenar posible proceso

Candidatura de mi esposa a gubernatura de SLP no sería nepotismo: Ricardo Gallardo; término se ha “desvirtuado”, dice

“Quienes nacieron in vitro no forman parte de la familia”; ministra María Estela Ríos desata polémica en sesión de la Corte

Grecia Quiroz acude a reunión en Palacio Nacional con Sheinbaum; buscan impulsar plan de atención a la violencia
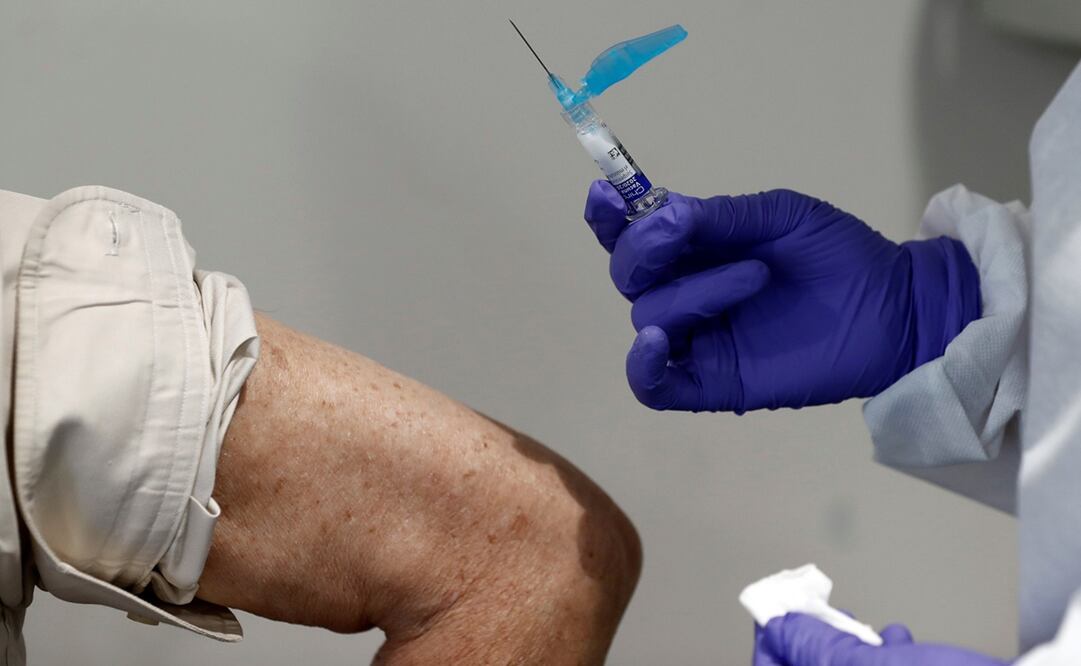
La Administración de Alimentos y Medicamentos ( FDA ) de Estados Unidos requerirá un seguimiento de dos meses a los voluntarios que se den una segunda dosis de una vacuna contra el coronavirus antes de otorgar la aprobación de emergencia, de acuerdo con una guía divulgada este martes.
Esa medida muy probablemente impedirá tener una vacuna en el mercado antes de las elecciones del 3 de noviembre, algo que el presidente Donald Trump , que se postula a la reelección, refiere con frecuencia como una posibilidad.
Lee también:
Trump comparó al Covid-19 con la gripe estacional
"Los datos de los estudios de fase 3 deben incluir una duración media de seguimiento de al menos dos meses después de completar el régimen de inoculación para proporcionar la información adecuada que permita evaluar el riesgo-beneficio de una vacuna", señalan los lineamientos de la FDA .
Las dos firmas más avanzadas en los ensayos de vacunas, Moderna y Pfizer, comenzaron sus etapas finales sobre fines de julio y ambas requieren una segunda dosis a los 28 días.
Ello implicaría que solo los pocos voluntarios que se apuntaron inicialmente a los ensayos estarían terminando el periodo de seguimiento a finales de octubre, y probablemente no habría suficiente información para solicitar una aprobación de emergencia.
"La FDA se compromete a que el proceso de desarrollo de la vacuna Covid-19 y nuestra evaluación científica sean lo más abiertas y transparentes posible", escribió el director de la agencia, Stephen Hahn, en Twitter.
Lee también:
Estima OMS que 10% del mundo se contagió
La decisión de divulgar la guía se produce en momentos de una disputa entre la FDA y la Casa Blanca.
Según los medios estadounidenses, la Casa Blanca considera innecesario el período de seguimiento de dos meses y no quiere que la FDA lo implemente.
La noticia fue bienvenida por los expertos en salud, que dijeron que la FDA demostraba estar actuando con responsabilidad ante las presiones políticas.
agv
Más Información
Noticias según tus intereses
ViveUSA
[Publicidad]