Jean Claude Zenklusen pensaba dedicar su carrera a las enfermedades neurológicas.
Pero una muerte en su familia lo marcó de tal forma que dio otro rumbo a su vida.
El científico, quien es suizo pero creció y vivió durante más de 20 años en Argentina, es el director del Atlas del Genoma del Cáncer en el Instituto Nacional del Cáncer en Estados Unidos, The Cancer Genome Atlas o TCGA.
El Atlas es el mayor proyecto de aplicación de genómica, o estudio de los genomas, al cáncer.
Zenklusen participó del proyecto internacional que secuenció por primera vez el genoma humano hace ahora dos décadas.
Y desde entonces investiga cómo usar la genómica para innovar en el diagnóstico y tratamiento del cáncer.
El investigador está convencido de que en el futuro para la mayoría de la gente "los tratamientos no van a ser la quimioterapia de hoy en día, no van a ser tratamientos medievales brutales, sino tratamientos que no arruinan la calidad de vida".
Jean Claude Zenklusen habló con BBC Mundo sobre cómo la genómica ya está ayudando a pacientes con cáncer, sobre sus esperanzas para el tratamiento de la enfermedad y sobre qué lo inspira para seguir adelante.
¿Por qué decidió dedicarse a estudiar el cáncer?
Yo soy químico y a menudo me preguntan eso. Siempre digo que tengo una razón personal; para mí el cáncer es mi enemigo personal.
Susana era una prima de mi madre. Cuando yo empecé la universidad con 20 años ella tenía 28, o sea que estaba mucho más cerca de mí que de mi madre.
Ella también acababa de recibirse de química, se casó, se fue de luna de miel a la India y empezó a tener una tos que no se le iba.
Cuando volvió fue al médico por esta tos, le hicieron una radiografía y le diagnosticaron un cáncer, un sarcoma no invasivo pero que básicamente estaba rodeando los pulmones.
Su amante esposo de dos semanas desapareció del mapa.
Ella vivía en una provincia en Argentina, en Tucumán, y como nosotros éramos la única familia que vivía en Buenos Aires se quedó a vivir con nosotros mientras la trataban con quimioterapia regular y radiación.
Esta joven de 28 años, vibrante, inteligente y bella se transformó en dos años de tratamiento en un pequeño esqueleto con algo de piel. Parecía alguien que había salido de Auschwitz.
Y después de dos años de tratamiento brutal se murió, finalmente tuvo paz. Pero no debería haber pasado por todo eso.
También lee: En México, hasta 4 mil 492 nuevos casos de cáncer de riñón por año
Yo en realidad tenía mucho más interés en estudios de enfermedades neurológicas, pero cuando Susana murió, el cáncer se transformó en mi enemigo personal.
¿Hace cuánto tiempo sucedió lo que nos relata?
De esto hace 34 años.
Usted participó del Proyecto del Genoma humano hace dos décadas. ¿Cómo comenzó a aplicarse ese conocimiento al cáncer?
Cuando yo hice mi doctorado en genética de cáncer, en aquel momento se hablaba de genética (herencia de uno o pocos genes) y no genómica, porque apenas conocíamos algunos genes.
Yo siempre uso una imagen que muestra cuánto de la biología del cáncer conocíamos cuando yo estaba estudiando para hacer mi doctorado y hay 30 genes y un montón de lugares donde hay signos de interrogación.
Las enfermedades se dividen en enfermedades genéticas y metabólicas.
Las metabólicas son enfermedades que se producen por un desbalance del metabolismo que no parece tener base en una mutación genética.
El Parkinson, por ejemplo, es una enfermedad metabólica que tiene muy poco elemento genético.
El cáncer, en cambio, tiene elementos metabólicos, pero es 95% genético.
Entonces, una vez tuvimos es genoma humano parecía obvio que teníamos que empezar por el cáncer, ya que aparece a través de mutaciones y de cambios en los genes.
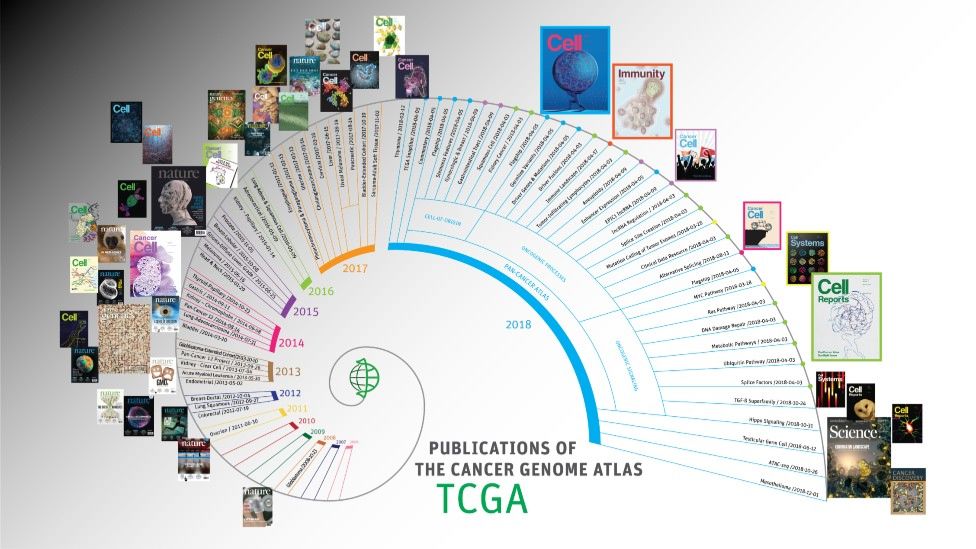
¿En qué consiste el Atlas del Genoma del Cáncer que usted dirige?
El Atlas fue simplemente la aplicación del genoma humano al problema de cáncer.
Lo que hicimos fue armar una colección de 33 tipos de tumores, la mayoría de ellos sólidos, solo dos hematológicos y todos de adultos (hay otro proyecto similar que es de pediátricos, Target).
Y lo que básicamente hemos hecho es una colección de los tumores, de los que se extrajo ADN, ARN y proteínas.
La idea del atlas era coleccionar toda la información posible sobre los cambios a nivel genómico en los tumores, porque se sospechaba con la acumulación de datos se podría dilucidar la razón detrás de la existencia de los distintos tumores, así como su comportamiento.
Es muy interesante, porque la gente piensa que esto es algo que se hizo para encontrar terapias, pero en realidad no.
Fue lo que en ciencia llamamos una "expedición de pesca". Esto es: usted va al lago, se pone en su bote, tira la línea y ve que es lo que encuentra.
No sabíamos qué nos íbamos a encontrar.
¿Es ese análisis del material genético en los tumores lo que permitió clasificarlos no por el órgano en que se encuentran, sino por sus características genéticas?
Sí. Por ejemplo, se sospechaba desde hace tiempo que no todos los tumores de riñón son iguales, porque tienen un desarrollo diferente, se ven distintos en el microscopio, y porque la respuesta a los tratamientos es diferente.
La mayoría de los tumores, hasta que empezamos a ver qué genes estaban involucrados, se trataban con quimioterapia estándar.
La quimioterapia empezó en 1957, cuando Gertrude Elion, en el Wellcome Trust, desarrolló un fármaco, el 5-fluorouracil (5-FU), que impide la duplicación de ADN y, por ende, la duplicación celular.
El asunto es que el 5-FU se ha usado por los últimos 70 años, y se sigue usando y es efectivo, pero es un tratamiento muy general.
Frena la replicación de todas las células, no solamente de las cancerosas, y por eso cuando la gente recibe quimioterapia tiene todos esos efectos secundarios que son horripilantes, como problemas gástricos, de piel, anemia.
Estamos diciéndole al cuerpo básicamente: "¡Para!".
Por eso la quimioterapia requiere vacaciones: el paciente recibe el ciclo de tratamiento, se enferma mucho, se para el tratamiento, esperando que la mayoría del tumor se haya muerto, y luego se vuelve a aplicar. Y así una y otra vez.
Es una manera muy primitiva de tratar.
¿Qué alternativas ofrece la genómica al tratamiento del cáncer?
Ahora, gracias no solamente al Atlas sino a muchos otros estudios, estamos aprendiendo que diferentes tumores se desarrollan de distintas maneras usando diversos genes.
Por ello, se están desarrollando un montón de fármacos específicos para ese gen y solo para ese gen.
El tumor es inhibido, pero el resto del paciente sigue funcionando perfectamente bien.
Lo que la gente ve con las targeted therapies o terapias específicas es que los efectos secundarios son mucho menores y los resultados mucho mejores.
Desgraciadamente, cuando empezamos con las terapias específicas el mensaje que se dio a la gente es que iban a resolver el problema del cáncer.
Es verdad, pero no lo puede resolver una sola terapia. Hay que combinar varias, porque el cáncer tiene la habilidad de mutar.
¿Puede darnos algún ejemplo de esas terapias específicas desarrolladas estudiando las características genéticas de los tumores?
Dije que hemos coleccionado 33 tipos de tumores, pero en realidad solamente pudimos hacer 32 proyectos.
La razón fue que, mientras estábamos coleccionando los tumores y gracias a los sistemas genómicos, Louis Staudt, mi jefe en el Instituto Nacional del Cáncer, descubrió que el linfoma difuso de células B, el linfoma más común, viene en dos grupos totalmente diferentes.
Y vio que había diferencias en las mutaciones que permitían tener una terapia dirigida específicamente a cada subtipo, lo que pasó inmediatamente a la clínica.
Ahora el 95 por ciento de los linfomas difusos de células B se curan.
No teníamos más muestras, porque la gente se curaba y no se hacían más biopsias, por lo que no pudimos hacer el proyecto.
En el cáncer de mama hay un montón de genes que han sido descubiertos y hoy en día hay tratamientos que son basados en todos esos hallazgos.
Sé que la gente siempre le pregunta por qué, si hay todos esos avances, entonces no están curando el cáncer…
Hay muchos fármacos que están siendo desarrollados gracias a lo que hemos descubierto, pero no han llegado al mercado.
Y hay algunos tumores que hemos estudiado de los cuales todavía no entendemos nada.
Uno de ellos es el cáncer de ovario.
La imagen que tenemos del ADN en este caso es muy compleja, hay muchos rearreglos y es un sistema totalmente diferente a los de otros tipos de tumores.
Tenemos los datos, pero toma tiempo entenderlos. Y una vez hecho eso, toma tiempo desarrollar las terapias.
Estamos tratando de comprender cómo las células tumorales interactúan con el cuerpo sano. Son cosas que no entendemos pero son vitales para hacer un tratamiento que sea efectivo.
Las razones por las que no estamos curando todos los cánceres hoy es porque hay un montón de datos que no entendemos todavía.
También lee: Nanocápsulas, herramienta en la lucha contra el cáncer
Otro avance de genómica que se suele citar son las biopsias líquidas. ¿Qué significa esto?
Cuando se hace una biopsia normal de un tumor sólido se encuentra dónde está el tumor, se usa una aguja, se penetra el tumor y se aspiran células.
Pero es bastante invasivo y suele ser doloroso. Por eso las biopsias se hacen únicamente cuando hay síntomas clínicos.
La biopsia líquida, en cambio, es una manera de hacer vigilancia para ver si el tumor está volviendo, porque las células de tumores se destruyen todo el tiempo y liberan a la sangre ADN y ARN.
Lo que estamos haciendo ahora es sacarle al paciente 10 mililitros de sangre, separar el plasma de las células y mirar después en el plasma si esas mutaciones que sabemos que tiene en el tumor original están apareciendo de nuevo.
Si vuelven a aparecer, sabemos que el tumor está creciendo otra vez aunque el paciente no tenga síntomas clínicos y aunque la imagen por MRI (imagen de resonancia magnética) o rayos X no lo demuestre.
Por biopsia líquida uno puede saber que un tumor está desarrollándose de nuevo alrededor de seis meses antes de que aparezca ningún rasgo en la imagen.
Y cuanto antes sepamos que el tumor está atacando de nuevo, más chances tenemos de tratarlo.
Esto solo pudo hacerse gracias a las tecnologías que analizan el genoma, porque ahora sabemos cuáles son las mutaciones y tenemos las herramientas para descubrir en cantidades infinitesimales si ese gen mutado está apareciendo en la sangre.
¿Cuándo habrá entonces un cura para el cáncer?
El problema es que cuando la gente piensa en cáncer piensa en una enfermedad.
En realidad el cáncer son algo así como 300 enfermedades diferentes.
Entonces, pedir "una cura" para el cáncer es lo mismo que pedir una (misma) cura para la gastritis, el eczema y la caspa.
Son cosas totalmente diferentes y no podemos tener una cura para todo.
Hay algunos tumores que son bastante fáciles de curar y los estamos curando, y hay otros que son muy complicados y para los cuales no creo que vayamos a tener una cura.
Lo que vamos a hacer es transformar estas enfermedades de enfermedades agudas y mortales en crónicas y tratables.
Yo sufro de diabetes y tengo que ver a mi endocrinólogo cada tres meses. ¿Hay una cura? Por ahora no.
De la misma forma, lo que hay que hacer es seguir tratando de que el cáncer pase de ser una sentencia de muerte en algunos casos a ser una enfermedad crónica.
¿Qué espera ver en un futuro no muy lejano?
Yo lo que siempre digo es que espero que antes de retirarme (me faltan 12 años) tengamos sistemas que permitan hacer diagnósticos de una manera sencilla, barata y portátil.
Porque el problema es que todo esto que estamos hablando de genómica solamente ocurre en los países del primer mundo y en hospitales muy sofisticados.
En la clínica de un pequeño pueblo no hacen un ensayo genómico.
Estamos trabajando para hacer sistemas que sean portátiles y que permitan hacer el diagnóstico de cáncer con un par de gotas de sangre en cualquier lado, en medio del Sahara o en Nueva York.
Es una de las cosas que yo estoy convencido de que va a pasar.
Y la otra cosa creo es que en 20 años, con más datos y una vez que sepamos cómo responden más pacientes a las distintas terapias, el cáncer no va a ser una sentencia de muerte.
Va a ser posible decir "tengo cáncer, está bien, tengo que hacer los tratamientos".
Para la mayoría de la gente los tratamientos no van a ser la quimioterapia de hoy en día, sino terapias que no son medievales, brutales, que no le arruinen la calidad de vida.
¿Qué es lo que más lo inspira a seguir adelante con su trabajo?
Mi mujer también trabaja en cáncer, y cuando estábamos haciendo el doctorado a veces me decía: "Estoy tan cansada de estos experimentos con ratones". Y yo le contestaba: "Vamos a sentarnos en el lobby del hospital por media hora".
Entonces íbamos a ver pasar a los pacientes, y como lo hacíamos más o menos seguido, veíamos cómo iban decayendo. Así que, después de 10 minutos, mi mujer me decía: "Sí, ya sé porque estamos haciendo esto".
Yo en mi escritorio tengo una foto de Susana. Hay días en los que tengo ganas de tirar todo a la miércoles, y cuando eso me pasa, miro la foto, y me digo que hay una razón para esto.
La mayoría de los que hacemos este tipo de trabajo tenemos muy en cuenta lo que sufren los pacientes, ya sea porque hemos tenido una experiencia personal o por altruismo humano, y somos gente muy dedicada.
Por eso yo creo que vamos a cambiar el sistema. El cáncer como sentencia de muerte tiene los días contados, no el paciente sino el cáncer.
Hay que sobrevivir lo suficiente para dar tiempo a que las nuevas terapias aparezcan.
Ahora puedes recibir notificaciones de BBC News Mundo. Descarga la nueva versión de nuestra app y actívalas para no perderte nuestro mejor contenido.
Noticias según tus intereses
[Publicidad]
[Publicidad]