Más Información
¿Sabías que 2019 es el Año Internacional de la Tabla Periódica?
Así lo declaró la Organización de Naciones Unidas (ONU) en honor a los 150 años desde que el químico ruso Dmitri Mendeléyev creó la primera versión, en 1869.
Mendeléyev encontró una solución para algo que había desvelado a los científicos por mucho tiempo: ¿cómo ordenar los elementos químicos?
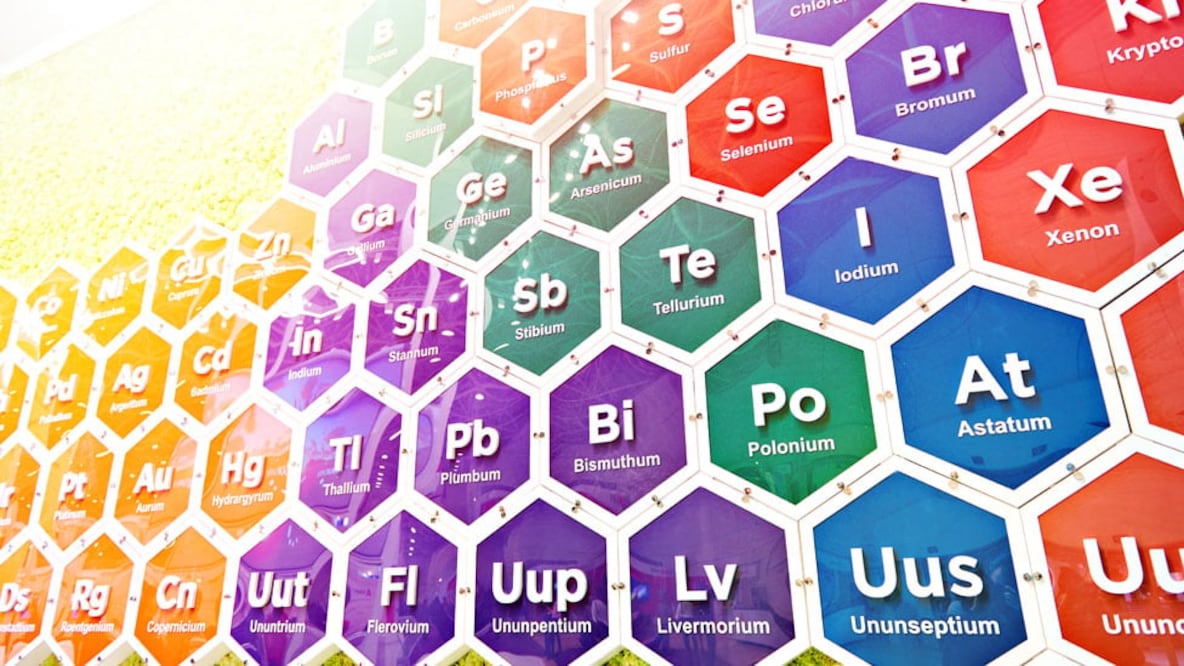
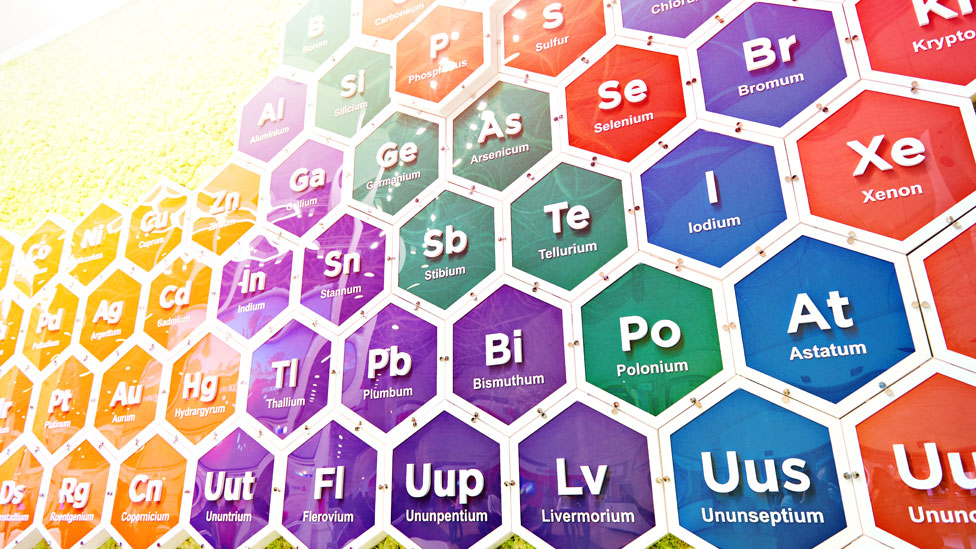
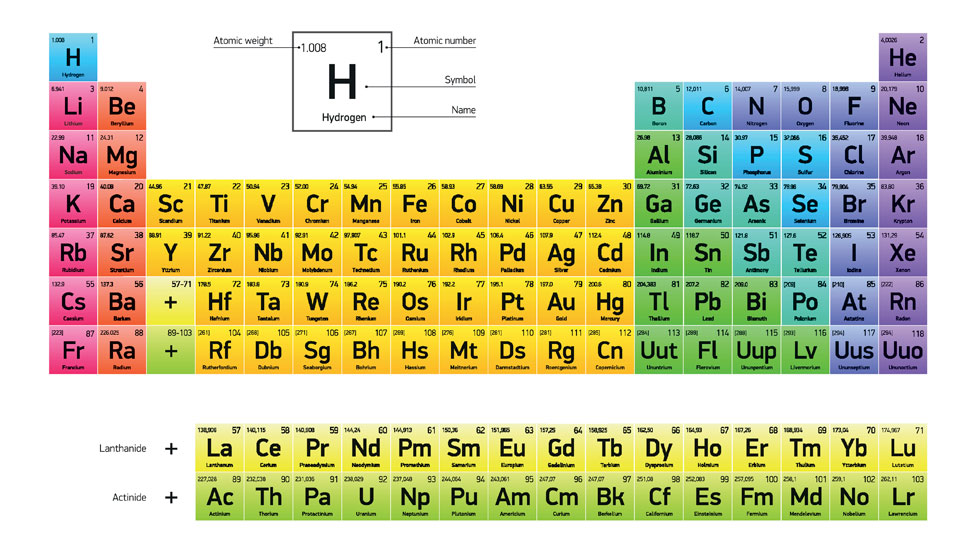
Su famosa tabla, que fue la primera ampliamente reconocida, los dispone según sus números atómicos, es decir: por la cantidad de protones y electrones que tienen en su núcleo.
- 7 preguntas sobre la tabla periódica, el famoso esquema creado por Dmitri Mendeléyev hace 150 años
- Qué elementos de la tabla periódica están amenazados (y qué tiene que ver con eso tu celular)
Otra de las genialidad del ruso fue agrupar los elementos con comportamientos similares en columnas.
Su famosa tabla tenía siete filas y ocho columnas, que enumeraban, de menor a mayor, los 63 elementos conocidos hasta ese momento.
Pero Mendeléyev fue tan visionario que incluso dejó espacios vacíos para elementos que aún no habían sido descubiertos.
Su predicción fue correcta: con el paso de los años esos elementos empezaron a hallarse y para 1925 la tabla periódica incluía todos los 92 elementos que ocurren en la naturaleza.
Pero los químicos no pararon allí. Empezaron a inventar elementos nuevos, creados en laboratorios.
Fue así como la taba periódica terminó teniendo los 118 elementos que contiene hoy.
Los últimos son recientes. El nihonio (elemento 113), moscovio (115), teneso (117) y oganesón (118) se incorporaron en 2016.
Y todo indica que en el futuro se hallarán más, lo que hace difícil imaginar que alguna vez se pueda completar la tabla periódica.
Sin embargo, ese no parece ser el objetivo de la ciencia hoy.
Los químicos dedicados a crear nuevos elementos tienen otra meta en mente. Esa meta se llama la Isla de la Estabilidad.
¿Qué es y cómo se llega?
Para entender eso, primero hay que conocer un poco sobre la historia de cómo se descubre un nuevo elemento químico.
Eso nos remonta al siglo XVII, cuando el alquimista aficionado alemán Hennig Brand intentó descubrir la "piedra filosofal", una sustancia legendaria que supuestamente podía convertir cualquier elemento en oro.
A Brand se le ocurrió experimentar con su propia orina. La dejó reposar, la hirvió hasta que se transformó en un residuo sólido, calentó ese residuo mezclado con arena y luego recogió el marerial blanco que dejó el vapor una vez que se secó.
Brand no halló la piedra filosofal pero sí el fósforo, y así se convirtió -en 1669- en la primera persona en descubrir un elemento nuevo a través de la química.
Decenas de elementos más fueron hallados en los años que siguieron. Pero el gran salto se dio en el siglo XIX, cuando el químico británico Humphry Davy desarrolló un nuevo método de identificación.
Davys utilizó la electrólisis, un proceso que separa los elementos de un compuesto por medio de la electricidad. Así logró, por ejemplo, determinar que la sal de mesa estaba compuesta de sodio y cloro.
También logró separar el magnesio, el bario, el estroncio, el calcio, el potasio, el boro y el litio.
Eventualmente se identificaron los 92 elementos que se producen de forma natural: desde el hidrógeno -el elemento 1, porque tiene un sólo protón y electrón en su núcleo- hasta el uranio, con 92.
Luego, con ayuda del laboratorio, llegaron los elementos sintéticos, conocidos también como "elementos transuránicos", que son más pesados y ocupan los últimos puestos de la tabla.
Efímeros
Pero estos nuevos elementos tienen un problema: son muy radioactivos y por ello no son estables, como los naturales.
"El motivo por el cual no existen en la naturaleza es porque tienen una vida media muy corta, se desintegran rápidamente", explicó a la BBC el experto nuclear atómico Jim Al-Khalili.
También señaló que lo más pesado el elemento -en términos de su número nuclear-, lo más difícil es crearlo. Incluso llega un punto donde su composición química se torna "borrosa" y difícil de catalogar.
Hay todo un campo de la ciencia que se dedica a estos elementos nuevos, llamados "superpesados".
Estos especialistas utilizan tecnologías de punta para crear nuevos superpesados. Fue así como descubrieron los cuatro elementos que fueron incorporados a la tabla periódica en 2016.
Pero lo que no han logrado hacer hasta ahora es crear un superpesado que dure más de un milisegundo.
Ese objetivo es lo que estos expertos llaman la Isla de la Estabilidad.
"Hay buenos motivos para pensar que eventualmente podremos llegar a crear un grupo de elementos que durarán por mucho más tiempo, eso es lo que se conoce como la Isla de la Estabilidad", explicó Al-Khalili.
"Si logramos crear elementos superpesados que perduren, capaz podemos empezar a usarlos en procesos químicos", agregó.
Así, teóricamente podríamos producir materiales nuevos con propiedades inimaginables.
Por eso, a 150 años de la creación de la tabla periódica, el objetivo ya no está puesto en la cantidad, sino en la estabilidad de los nuevos elementos que se sumen.
Este artículo está basado en un capítulo del programa de radio "Los casos curiosos de Rutherford y Fry" de BBC Radio 4. Puedes oirlo (en inglés) aquí
Ahora puedes recibir notificaciones de BBC News Mundo. Descarga la nueva versión de nuestra app y actívalas para no perderte nuestro mejor contenido.
https://www.youtube.com/watch?v=kw3FYvWT-Po
Noticias según tus intereses
[Publicidad]
[Publicidad]